孙毅组揭示LSD1调控E3连接酶FBXW7的分子机制
5月31日,孙毅教授课题组在《PNAS》杂志上以直接投稿的方式(Direct submission plus)在线发表题为“LSD1 destabilizes FBXW7 and abrogates FBXW7 functions independent of its demethylase activity”的研究论文 (4) (https://doi.org/10.1073/pnas.1902012116),揭示了LSD1通过去甲基化酶活性非依赖性途径调控FBXW7稳定性和功能的分子机制。
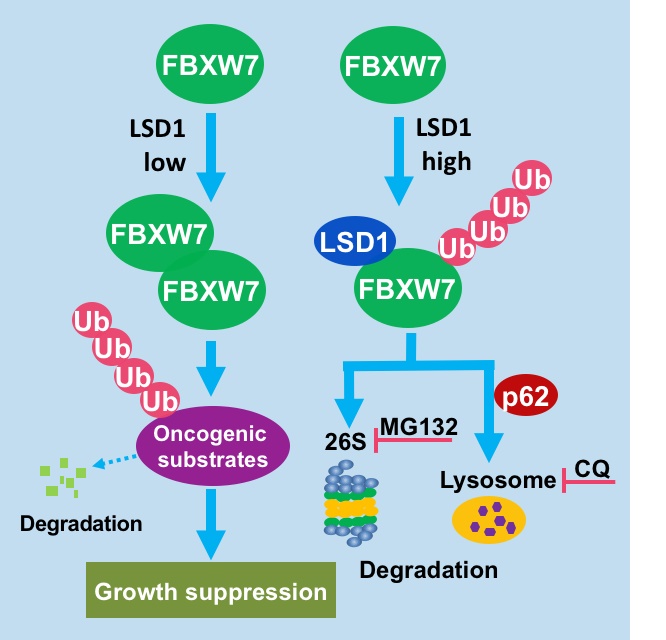
在这项研究中,研究人员通过一系列严谨而系统的分子生化实验发现,LSD1是FBXW7的一个假底物。FBXW7可以通过经典的结合位点与LSD1特异性结合,然而二者的结合却并不催化LSD1的多泛素化降解。反过来,LSD1可以通过打断FBXW7的二聚体形成而促进FBXW7的自身泛素化,最终影响FBXW7的蛋白质稳定性(下图)。重要的是,LSD1对FBXW7的这一调控过程,不依赖于其去甲基化酶活性,而依赖于LSD1与FBXW7之间的直接结合。随后,本研究进一步首次证实泛素化的FBXW7除了通过蛋白酶体途径降解之外,还可以通过p62介导的自噬溶酶体途径降解(下图)。生物学功能上,LSD1能通过负性调控FBXW7的稳定性而抑制其在细胞增殖、NHEJ修复和离子辐射保护等方面的作用。
该研究主要由孙毅教授实验室的博士生蓝辉银完成,是为该文的第一作者。孙毅教授为通讯作者。多名浙江大学和密西根大学的研究人员参与了该项工作。
参考文献:
1.Welcker M & Clurman BE (2008) FBW7 ubiquitin ligase: a tumour suppressor at the crossroads of cell division, growth and differentiation. Nat Rev Cancer 8(2):83-93.
2.Shi Y, et al. (2004) Histone demethylation mediated by the nuclear amine oxidase homolog LSD1. Cell 119(7):941-953.
3.Fu X, Zhang P, & Yu B (2017) Advances toward LSD1 inhibitors for cancer therapy. Future Med Chem 9(11):1227-1242.
4.Lan H, et al. (2019) LSD1 destabilizes FBXW7 and abrogates FBXW7 functions independent of its demethylase activity. Proceedings of the National Academy of Sciences.
5.Gu S, Cui D, Chen X, Xiong X, & Zhao Y (2018) PROTACs: An Emerging Targeting Technique for Protein Degradation in Drug Discovery. Bioessays 40(4):e1700247.


