Biomaterials丨王本团队:肿瘤钙化促进糖脂代谢转换以逆转肿瘤化疗耐药
目前临床上几乎所有的化疗药物在使用过程中都可诱导肿瘤耐药。肿瘤耐药会引起肿瘤复发或转移,从而导致治疗失败。代谢转变是癌症的特征之一。目前已有研究发现,癌细胞通过代谢重编程,依赖脂肪酸代谢实现治疗抵抗。因此,寻找能阻碍或逆转从依赖糖酵解到依赖脂肪酸氧化转换的有效方法,有望逆转化疗耐药。
多年来,浙江大学转化医学研究院/浙江大学医学院附属第二医院王本课题组致力于通过细胞表面工程化的手段诱导癌细胞钙化以实现肿瘤的精确诊断和有效治疗。目前课题组已经开发了一系列肿瘤钙化诊断和治疗的新策略(Angewandte Chemie International Edition, 2021, 60(12): 6509-6517; Advanced Functional Materials, 2021: 2101284)。
近日,王本课题组开发了一种能诱导顺铂(Pt)耐药的宫颈癌细胞发生微钙化的大分子药物(folate-polySia, FpSA)。在生理条件下,一定浓度的FpSA能靶向耐药细胞并富集血钙离子至细胞膜使细胞表面发生自发钙化—微钙化。微钙化对耐药细胞并不会产生直接的杀伤力,但会使肿瘤细胞内线粒体功能紊乱、脂肪酸摄取减少和脂肪酸β-氧化障碍,依赖糖酵解代谢途径。体内外实验结果显示Pt和FpSA联合治疗能有效抑制顺铂耐药肿瘤的生长,提高荷瘤小鼠的存活率。研究表明,微钙化肿瘤中,FpSA将脂肪酸代谢转变为糖酵解,增加顺铂耐药细胞的化疗敏感性。FpSA诱导癌细胞钙化为化疗耐药肿瘤的治疗提供了一种代谢重编程的新策略。该研究成果以“Cell calcification reverses the chemoresistance of cancer cells via the conversion of glycolipid metabolism”为题,2024年10月10日在线发表在Biomaterials上。

首先,研究者在体外探究微钙化对化疗耐药细胞敏感性的影响。细胞活力检测实验结果表明低浓度FpSA 诱导的微钙化能增加顺铂耐药的宫颈癌细胞(HeLa/DDP)对顺铂的敏感性(图1A),即微钙化处理能降低HeLa/DDP 细胞的顺铂耐受浓度。接着研究者通过电感耦合等离子体质谱(ICP-MS)法直接测定细胞内顺铂浓度(图1B-C),探究顺铂对微钙化细胞更具有杀伤力的直接原因。检测结果显示,和正常培养的细胞相比,诱导处理后的HeLa/DDP 细胞内顺铂浓度较高。并且与基因组DNA结合的顺铂浓度也增加,从而导致更多的细胞死亡。另外FpSA能诱导HeLa/DDP细胞进入早期凋亡阶段,并阻滞在G1期(图1D-E)。这些因素提高了耐药细胞对顺铂杀伤的敏感性。

图1. FpSA诱导细胞微钙化能增强化疗耐药癌细胞的敏感性。
接着,研究者建立了宫颈癌顺铂耐药HeLa/DDP 细胞裸鼠皮下移植瘤模型,探究在体内FpSA诱导癌细胞微钙化能力以及对耐药细胞的化疗增敏效果。给药30 天后,单药FpSA 给药组的肿瘤抑制率(TGI)为52.98%,双药FpSA+Pt 给药组的TGI 为78.7%,显示组合给药组良好的抑瘤效果(图2A)。Kaplan-Meier 生存曲线表明双药FpSA+Pt 给药组小鼠的生存期都超过了60 天(图2C)。离体肿瘤的HE 染色结果显示FpSA+Pt 给药组的肿瘤组织内大量肿瘤细胞坏死(图2E)。在HeLa/DDP 细胞裸鼠皮下瘤的治疗实验中,低浓度FpSA也显示了其增加顺铂化疗敏感性的能力。同时研究者通过体重变化、血生化检测等,对抑瘤效果良好的双药治疗方案进行了生物安全性评估(图2B,E-F)。
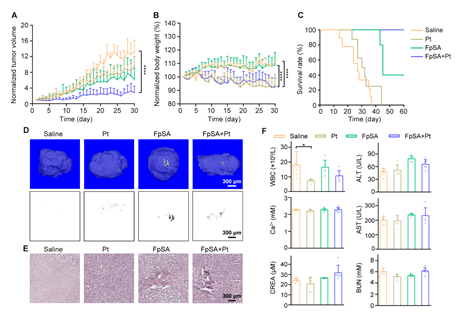
图2. FpSA 抑制人宫颈癌顺铂耐药细胞裸鼠皮下移植瘤生长,增加移植瘤对顺铂的敏感性。
目前已有研究报道,卵巢癌等癌细胞通过糖酵解转换为脂肪酸摄取和β-氧化的代谢途径获得耐药性。为了研究FpSA参与HeLa/DDP细胞增敏性的潜在机制,研究者对离体肿瘤进行转录组学和蛋白组学分析。分析结果表明FpSA通过干预脂质代谢途径,逆转肿瘤顺铂耐药表型(图3A-B)。体外实验证实,FpSA降低HeLa/DDP细胞内中性脂和甘油三酯的浓度(图3C-E)。FpSA也一致降低了细胞内甘油-3-磷酸脱氢酶1 (GPD1)在转录水平和蛋白水平的表达(图3F-G)。和蛋白质组学结果一致,qPCR和WB结果显示,在经处理后细胞内的脂肪酸摄取相关的蛋白质(如CD36和FABP4)表达水平下降(图3H-I),提示FpSA诱导的肿瘤细胞钙化会阻碍细胞对脂肪酸的摄取(图3J)。
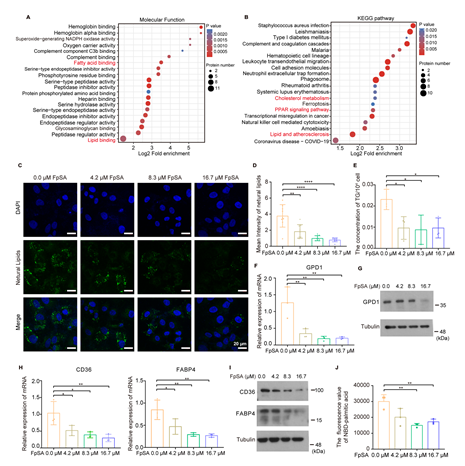
图3. FpSA诱导的微钙化导致肿瘤细胞的脂质代谢转换。
考虑到FpSA参与调节脂质代谢,脂质的主要功能是通过脂肪酸氧化(fatty acids oxidation, FAO)产生能量,于是研究者猜测FpSA影响耐药细胞线粒体中的FAO,阻断脂肪酸摄取。和蛋白质组学分析一致,FpSA处理后ACSL1的表达急剧下降(图4A-B)。那么ACSL1的下调是否进一步影响线粒体的功能呢?共聚焦激光扫描显微镜(CLSM)图像显示,HeLa/DDP细胞微钙化后线粒体活性降低(图4C)。透射电子显微镜(TEM)图像显示线粒体断裂、形态改变(图4D)。相应地,FpSA处理后ATP产物急剧下降(图4F),耗氧率(OCR)和FAO速率降低(图4G-J)。总的来说,FpSA会抑制脂肪酸的β-氧化。
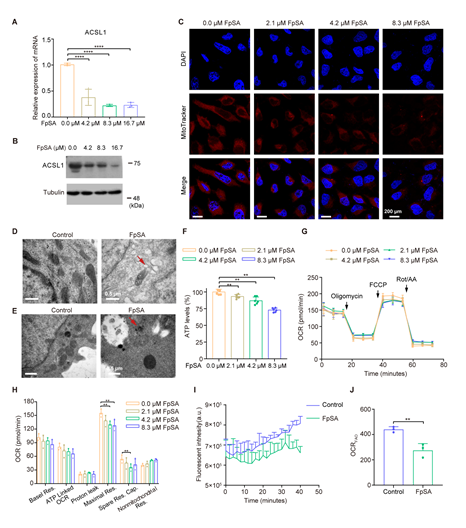
图4. 正常生理条件下FpSA诱导的微钙化降低顺铂耐药宫颈癌细胞的脂肪酸氧化。
为了检验FpSA是否影响替他代谢途径,研究者通过代谢组学探讨了糖酵解和TCA代谢产物的丰度变化。FpSA处理后,细胞内果糖-1,6-二磷酸(F1,6P)、磷酸二羟丙酮(DHAP)和甘油醛3-磷酸(GAP)增加(图5A)。而TCA的代谢物减少,但不明显(图5B)。在微钙化细胞中,NADPH和GSH倾向于向氧化状态移动,顺铂诱导的氧化应激增加(图5C)。与图4F结果一致,ATP丰度下降(图5D)。此外,糖酵解通量取决于葡萄糖的摄取。2-NBDG的荧光强度检测结果表明耐药细胞的葡萄糖利用增加(图5E)。细胞外酸化率(ECAR)测定结果表明糖酵解活性增加(图5F-J)。综上所述,FpSA作为一种微钙化药物,能够将脂肪酸代谢逆转为糖酵解,从而增强对顺铂的敏感性,导致顺铂耐药细胞在化疗处理下死亡。
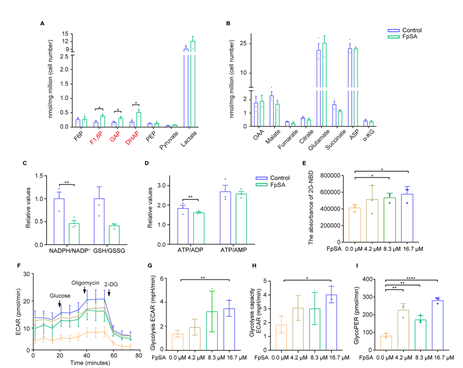
图5. FpSA诱导的微钙化影响顺铂耐药宫颈癌细胞的葡萄糖代谢。
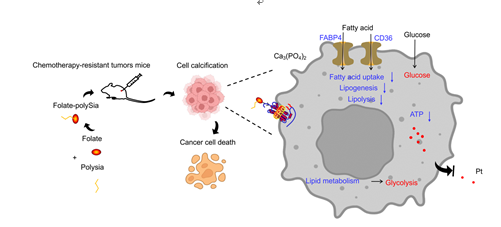
图6. FpSA对化疗耐药细胞增敏和糖脂代谢转换的作用机制模式图。
综上所述,本研究提出了自发诱导细胞外钙化的方法,以逆转癌症的化疗耐药,并提供了基于钙化的糖脂代谢转换用于癌症治疗的概念(图6)。叶酸受体的表达量决定FpSA诱导的肿瘤细胞微钙化状态,从而影响耐药细胞的易感性。此外,FpSA还影响耐药细胞系的膜流动性。FpSA可能通过细胞膜上的脂质蛋白介导代谢重编程,其中细胞膜流动性可能影响脂质蛋白的表达(如CD36)。在今后的研究中,膜流动性与脂质变化之间的关系值得进一步探索。
浙江大学医学院附属第二医院张利红博士,浙江中医药大学孙艳娣博士,浙江大学医学院附属第二医院林银丹是论文共同第一作者。浙江大学基础医学院骆严教授、转化医学研究院/浙江大学医学院附属第二医院王本教授为论文的共同通讯作者。本研究得到国家重点研发计划项目、国家自然科学基金、浙江省自然科学基金、浙江省创新创业领军团队和经血管植入器械全国重点实验室等项目的支持,并得到浙江大学转化医学研究院公共技术平台和实验动物中心的大力支持,在此一并致谢。
招聘
王本交叉学科团队致力于细胞表面化学生物学和转化医学的研究工作,欢迎有志于学术发展,具有化学、生物和药学、医学背景、志同道合的博士研究生和博士后加入团队,请联系[email protected]
原文链接:https://www.sciencedirect.com/science/article/pii/S0142961224004204


