ACS Nano|王本课题组:含氟高分子组装药物实现化药-免疫级联癌症治疗
经典的化疗药物如阿霉素能够诱导肿瘤细胞发生免疫原性死亡,随后CD8+ T细胞被激活并介导抗肿瘤免疫反应。然而,实体瘤中的CD8+ T细胞在肿瘤抗原的持续刺激下将转变为耗竭T细胞,并表现为细胞毒作用的下降,最终弱化抗肿瘤和抗转移的治疗效果。
近日,浙江大学转化医学研究院/浙江大学医学院附属第二医院王本课题组在ACS Nano杂志上发表了题为Chemoimmunological Cascade Cancer Therapy Using Fluorine Assembly Nanomedicine的研究论文,报道了一种由共载化药-基因的含氟高分子组装药物重编程化疗和免疫细胞的治疗策略。搭载阿霉素的高分子组装药物诱导肿瘤细胞发生免疫原性死亡,并通过小干扰RNA逆转耗竭CD8+ T细胞,有效发挥其抗肿瘤免疫作用。在乳腺癌和黑色素瘤小鼠模型中,高分子组装药物均表现出对癌症免疫治疗的强化作用,以及显著地抑制肿瘤生长和转移的能力。

阿霉素作为经典的抗肿瘤药物,除了能破坏DNA直接杀伤细胞外,还能触发细胞产生损伤相关分子模式导致免疫原性细胞死亡,进而刺激树突状细胞(DC细胞)的成熟,促进效应T细胞的浸润。然而,在对实体瘤的治疗中,肿瘤微环境会通过各种调控手段阻碍抗肿瘤免疫作用,诱导暴露在肿瘤微环境中的T细胞的共抑制受体表达增加,I型免疫细胞因子的产生和增殖能力下降,这种T细胞耗竭的状态,阻碍了化疗药物的抗肿瘤免疫作用。因此,有必要设计一种在递送化疗药物的同时调控肿瘤微环境中的免疫细胞以高效发挥抗肿瘤免疫治疗效果的药物。
研究表明,胸腺细胞选择相关高迁移率群盒蛋白(TOX)在耗竭T细胞中上调,因此,靶向下调TOX水平有望恢复CD8+ T细胞的抗肿瘤功能,并增强免疫原性化疗。本研究设计了一种活性氧和pH 双响应的含氟高分子组装药物,递送靶向TOX相关基因的小干扰RNA和阿霉素,构建免疫原性死亡和逆转免疫抑制桥梁。化药-免疫级联疗法显著增强了阿霉素的抗肿瘤作用,促进DC细胞的成熟,上调效应T细胞的水平和细胞因子的分泌,并抑制了免疫检查点蛋白的表达。综上,这项研究证明了逆转T细胞耗竭有望促进传统药物的化疗效率,化药-基因组合组装药物提供了一种对抗恶性肿瘤和转移的具有临床转化前景的治疗策略。
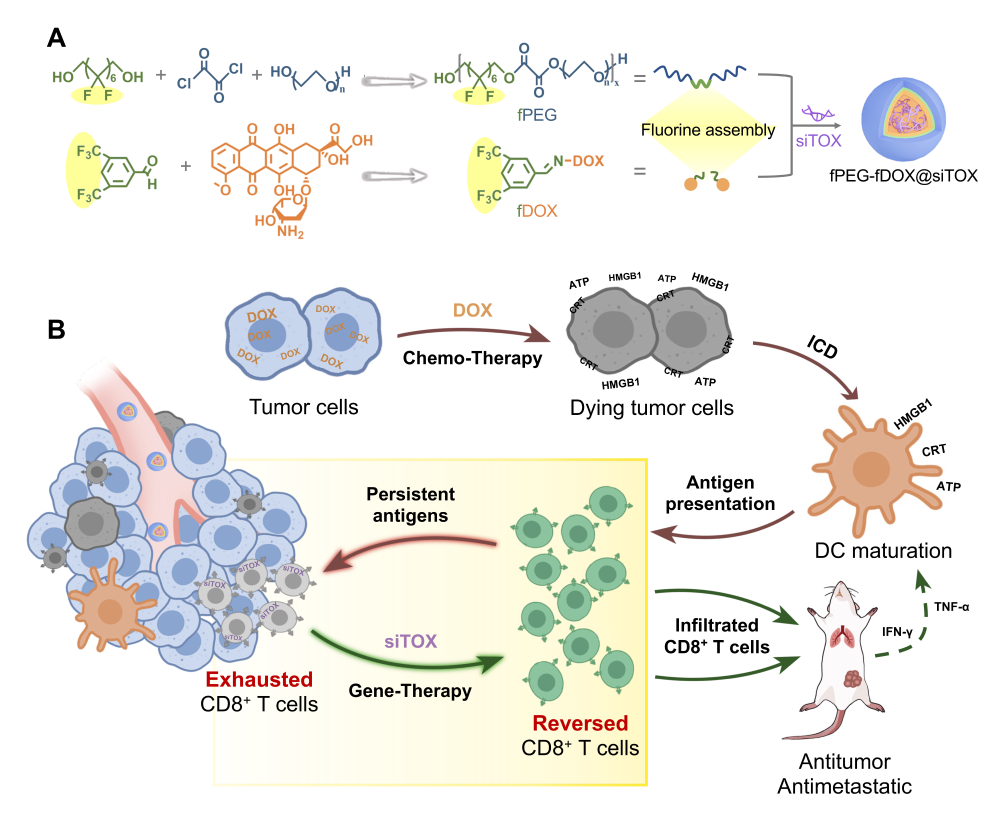
图1. (A) 含氟高分子组装药物的构建。(B)化药-免疫级联癌症治疗。
浙江大学转化医学研究院2020级博士研究生张清妍为论文的第一作者,王本为通讯作者。本研究受到了国家重点研发计划前沿生物技术项目和政府间合作重点专项、国家自然科学基金,以及中央高校基本科研业务费等资助完成。
参考文献
Qingyan Zhang, Pengkai Wu, Jicheng Wu, Hao Shou, Xinliang Ming, Shuqi Wang, and Ben Wang*. Chemoimmunological Cascade Cancer Therapy Using Fluorine Assembly Nanomedicine. ACS Nano. 2023
DOI: 10.1021/acsnano.2c12600
原文链接:https://pubs.acs.org/doi/10.1021/acsnano.2c12600


